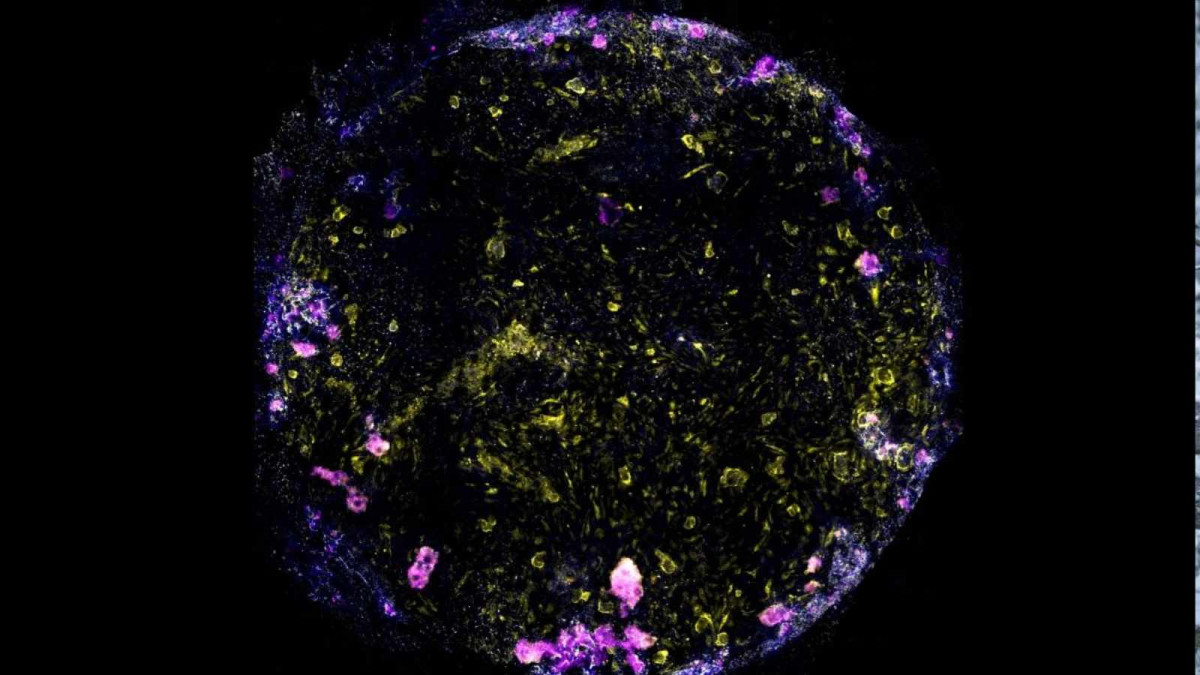
Snímek plic na čipu s buněčnými jádry (modrá), makrofágem (magenta), endoteliálními buňkami (žlutá) a těsnými spoji mezi epiteliálními a endoteliálními buňkami (bílá). Credit: Jakson Luk, Science Advances.
Tuberkulóza provází lidstvo tisíce let a stále má na svědomí více životů než jakýkoliv jiný infekční patogen. Přesto o jejích počátečních fázích víme překvapivě málo. Vědci nyní představili unikátní model „plic na čipu“. Nejde o elektroniku, ale o fascinující bioinženýrství, které dýchá a reaguje jako skutečná lidská tkáň. Tento nástroj odhaluje, co se děje v těle měsíce předtím, než se objeví první příznaky.
Proč myši nestačí
Tuberkulózou je nakažena přibližně čtvrtina lidské populace. Ačkoliv onemocní jen zlomek infikovaných, stále to celosvětově znamená více než 10 milionů nových případů a přes milion úmrtí ročně. Zákeřnost nemoci spočívá v jejím pomalém nástupu – od infekce k prvním příznakům často uplynou celé měsíce. Vědci toto období nazývají „černou skříňkou“, protože přesně nevíme, co se během něj v plicích odehrává.
Tradiční výzkum se spoléhal na pokusy na myších. Jak ale upozorňuje Max Gutierrez z Institutu Francise Cricka, zvířecí a lidská imunita se liší. Myši zkrátka nejsou lidé a léky, které fungují u hlodavců, mohou u člověka selhat. Vědci proto museli najít způsob, jak dostat lidské plíce do laboratoře.
Není čip jako čip: Jak to funguje?
Když vědci mluví o „orgánu na čipu“ (organ-on-a-chip), nemají na mysli křemíkovou destičku plnou tranzistorů, kterou znáte z počítače. Jde o průhledné zařízení z polymeru, velké zhruba jako USB klíčenka, které v sobě ukrývá systém miniaturních kanálků (mikrofluidiku). Tyto kanálky fungují jako mikroskopické potrubí pro tekutiny a vzduch.
Pro lepší představu můžeme tento čip přirovnat k dvoupatrovému domu:
1. Horní patro (Vzduch): Zde vědci vypěstovali buňky plicních sklípků, které jsou v přímém kontaktu se vzduchem – stejně jako když se nadechnete.
2. Mezipatro (Membrána): Obě patra odděluje tenká, polopropustná membrána. Ta simuluje bariéru v našich plicích, přes kterou prochází kyslík do krve.
3. Spodní patro (Krev): Zde proudí tekutina s živinami a nachází se zde buňky cévních stěn.
Celé zařízení je napojeno na pumpy, které simulují průtok krve a dokonce i mechanické roztahování a stahování membrány. Čip tedy doslova „dýchá“. To vytváří prostředí, které je na hony vzdálené obyčejným buňkám v plastové misce.
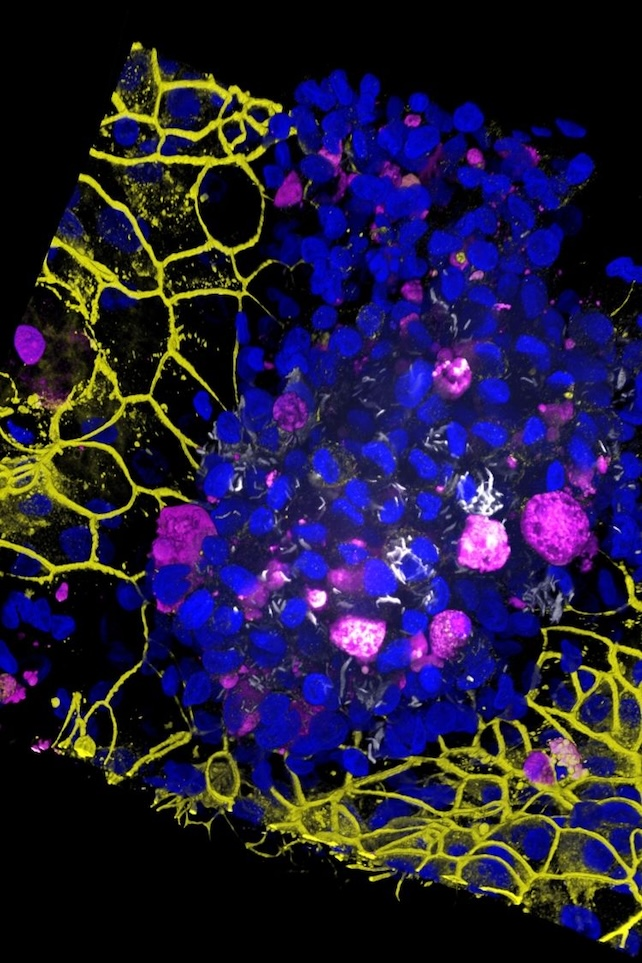
Plíce na čipu infikované bakterií Mycobacterium tuberculosis, s buněčnými jádry (modře), mrtvým makrofágem (purpurově/magenta), těsnými epiteliálně-endoteliálními spoji (žlutě) a bakteriemi tuberkulózy (bíle). (Jakson Luk/Science Advances)
Revoluce: Vše z jednoho dárce
Podobné modely existovaly už dříve, ale měly zásadní vadu. Byly sestaveny jako skládačka z buněk různých dárců a z komerčně dostupných vzorků. To vytvářelo genetický „guláš“, který neodpovídal realitě jednoho pacienta.
Nový model tento problém vyřešil elegantně. Výzkumníci použili lidské kmenové buňky (univerzální buňky, které se mohou přeměnit na jakýkoliv typ tkáně). Díky tomu vypěstovali jak buňky pro „horní patro“ (plíce), tak pro „spodní patro“ (cévy) od jednoho jediného dárce. Všechny buňky na čipu tak byly geneticky identické, přesně jako v lidském těle.
Souboj imunity v přímém přenosu
Aby otestovali funkčnost modelu, vpustili vědci na čip imunitní buňky zvané makrofágy (doslova „velcí jedlíci“, kteří pohlcují vetřelce) a následně je infikovali bakterií tuberkulózy. Mohli tak v reálném čase sledovat bitvu o přežití.
Výsledky věrně kopírovaly realitu. Vědci pozorovali vznik shluků makrofágů s takzvanými „nekrotickými jádry“ – což jsou skupiny mrtvých imunitních buněk obklopené těmi živými. Pět dní po infekci se bariéra mezi patry zhroutila, což simulovalo selhání funkce plic.
Budoucnost léčby šité na míru
Tento objev má obrovský potenciál pro personalizovanou medicínu. Každý člověk má totiž trochu jinou genetickou výbavu, která ovlivňuje, jak se jeho tělo s infekcí vypořádá. Vědci to potvrdili experimentem, kdy z buněk odstranili gen ATG14. Makrofágy bez tohoto genu umíraly snadněji a infekce postupovala rychleji.
V budoucnu by lékaři mohli odebrat buňky konkrétnímu pacientovi, vytvořit jeho osobní „plíce na čipu“ a na nich otestovat, která antibiotika zaberou nejlépe, ještě než je pacient začne užívat. To by mohlo zachránit tisíce životů a zefektivnit boj s touto prastarou nemocí.
Zdroje pro hlubší bádání
Studie: A human iPSC-derived multicellular lung-on-chip model (Science Advances)









